"Las partículas que forman un sistema material no están quietas, se mueven. La energía que poseen es proporcional a la temperatura."
"Existen unas fuerzas atractivas que tienden a juntar las partículas."
El elemento químico fundamental de la materia orgánica es el Carbono (C) que: En las moléculas orgánicas se une directamente con el Hidrógeno (H) se combina con otros átomos de carbono formando largas cadenas de átomos de carbono, muy grandes y complejas (diversidad de compuestos => diversidad de seres vivos), combinado con el oxígeno forma el CO2, gas muy soluble y que reacciona con facilidad pudiendo originar compuestos de carbono reducidos (compuestos orgánicos).
Los cuatro elementos químicos que mayoritariamente forman la materia de los seres vivos les llamamos bioelementos fundamentales o primarios, son el carbono (C), hidrógeno (H), oxígeno (O) y nitrógeno (N).
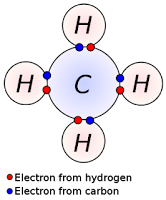 |
Esta imágen muestra los enlaces covalentes del carbono
|
El carbono, elemento fundamental de la materia orgánica con un átomo posee cuatro electrones de valencia los cuales posibilitan la formación de cuatro enlaces covalentes, que pueden ser sencillos, dobles o triples.
Las biomoléculas orgánicas están formadas por cadenas de carbono y se denominan Glúcidos, Lípidos, Prótidos y Ácidos nucleicos.
 |
| Algunos tipos de glúcidos |
Los glúcidos son biomoléculas orgánicas. Están formados por Carbono, Hidrógeno y Oxígeno, aunque además, en algunos compuestos también podemos encontrar Nitrógeno y Fósforo. Reciben también el nombre de azúcares, carbohidratos o hidratos de carbono.
Monosacáridos: Las unidades químicas mas pequeñas a partir de las cuales se forman los glúcidos, la unión de muchos monosacáridos constituye un polisacarido. Los cuales sirven como combustible y de reserva energética principalmente.
| Ácidos grasos |
Los ácidos grasos son los sillares a partir de los cuales se forman todos los lípidos. Una importante característica de estos es de reserva de energía a medio y largo plazo. Cuando hay carencia de glúcidos, la célula utiliza estas moléculas para obtener de ellas (rompiendo sus enlaces químicos) la energía necesaria para realizar sus funciones vitales.
Los glúcidos y ácidos nucleicos son un ejemplo de los tipos proveedores energéticos que necesitan los seres vivos para su básica supervivencia.
Por lo que es muy importante que los seres humanos tengamos una alimentación en donde se incluyan este tipo de alimentos para tener una buena nutrición.
Otros bioelementos secundarios, son el fósforo (P), el azufre (S), el sodio (Na), el potasio (K), el calcio (Ca), el cloro (Cl) y el magnesio (Mg).
Los demás elementos solo se encuentran en cantidades muy pequeñas aunque son indispensables para el funcionamiento de los seres vivos: los llamamos oligoelementos, como lo son el hierro (Fe), el yodo (I), el cobre (Cu), el zinc (Zn), silicio (Si) y otros más.
Referencias:
- Componentes Químicos de la Materia Viva. Diciembre 28, 2015, de Fundación Educativa Santo Domingo Sitio web: https://www.google.com.mx/url?sa=t&source=web&rct=j&url=http://kokemj.webcindario.com/apuntes%2520eso/APUNTES%2520BIOQUIMICA.pdf&ved=0ahUKEwjq-rnBgoDKAhUDLyYKHR-MCtIQFggYMAA&usg=AFQjCNHbwr_PjYRcIAxoYk60-5780zn4oQ&sig2=xhCg5ZMAbLMNTLXFlHe3uQ
- Aranda, A.. (No). La materia viva. Diciembre 28,2015, de I.E.S. Torre Olvidada Sitio web: https://www.google.com.mx/url?sa=t&source=web&rct=j&url=http://www.juntadeandalucia.es/averroes/~23000180/ciencias/ESO3/materia_viva.pdf&ved=0ahUKEwjY5KTLhIDKAhWJ4yYKHeNlB7QQFggYMAA&usg=AFQjCNGYqbsTeTk0UjvPmSX2l8A-e8HfKw&sig2=3Yy1W7JI8urV4fKzJWUSaQ










